膵臓管腺癌におけるSPP1–GREM1軸が細胞運命と転移を制御する分子メカニズム
SPP1(オステオポンチン), BMP2, GREM1といった骨代謝研究者にはなじみの深い分子がたくさん出てくるこの論文は、膵臓管腺癌(PDAC)の進行と細胞運命決定メカニズムを明らかにしたものです。
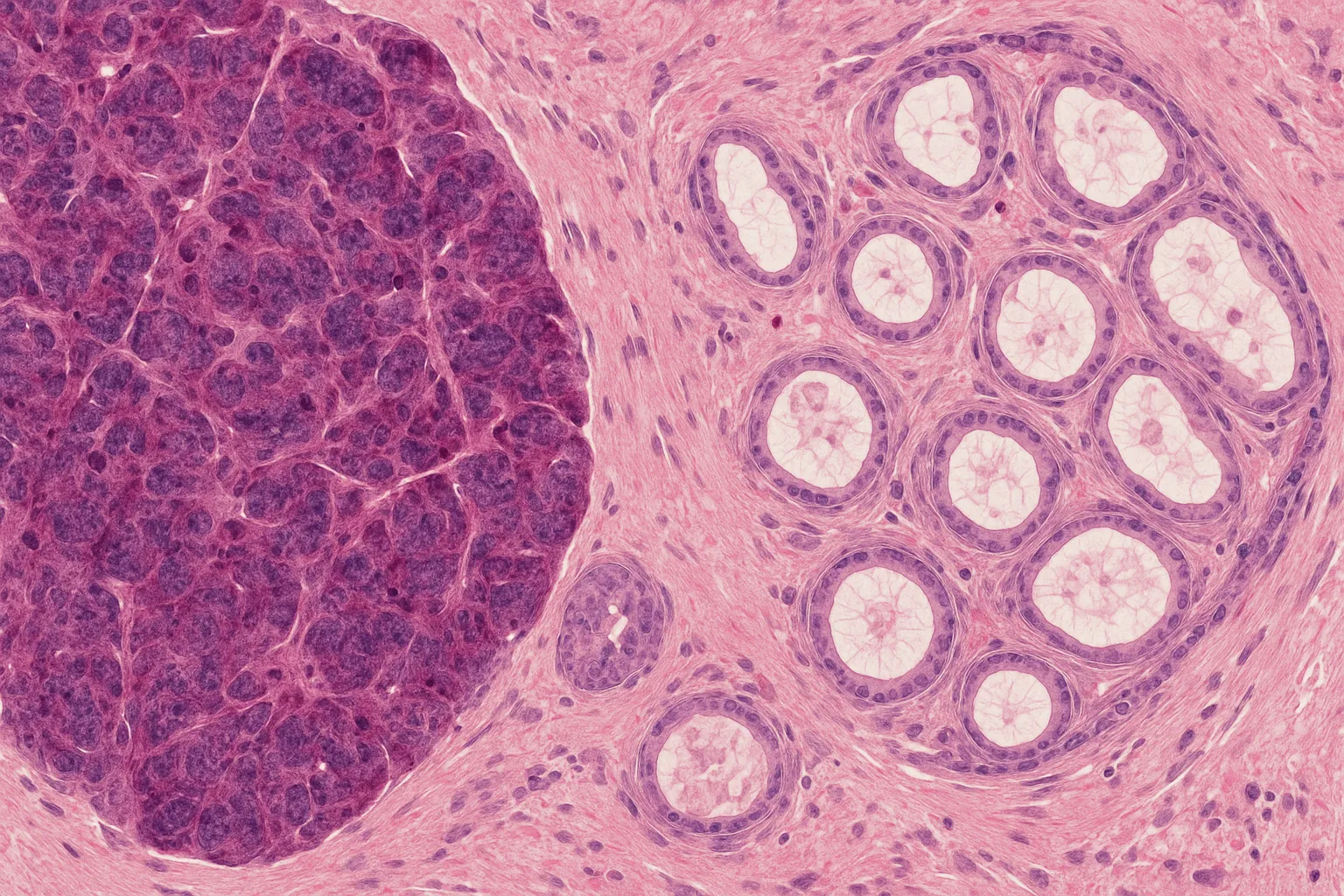
まず著者らは患者血漿のプロテオミクス解析により、進行期(ステージIII/IV)のPDACでSPP1の発現が著しく上昇していることを示しました。免疫組織染色では、SPP1は主に上皮系のPDAC細胞で発現している一方、間葉系細胞では見られませんでした。
マウス由来の膵腫瘍オルガノイドでSPP1遺伝子を欠損させたところ、VIM陽性間葉系PDAC細胞の割合が減少し、上皮系細胞への変化が促進されました。SPP1の過剰発現は逆の作用を示しました。
さらにこの作用はSSP1が受容体CD61(ITGB3)と結合することによるBMP2とGREM1の発現誘導を介していることが明らかになりました。SPP1がCD61に結合とNF-κB活性化を介してBmp2の発現を促し、GREM1の誘導と間葉系細胞としての性状が維持されます。逆に、GREM1はBMPシグナルを阻害し、上皮系細胞への分化を促進します。
興味深いことに、Spp1遺伝子をマウスモデルで欠損させると、PDACの発生や転移が著しく抑制されました。Spp1欠損マウスでは、腫瘍がより上皮系細胞の性状を示し、腫瘍の進行や肝・肺への転移が減少し、寿命も延長しました。これらは、SPP1がPDACの間葉系細胞性状の保持と転移促進に不可欠な因子であることを示しています。
結論としてGREM1とSPP1は互いに拮抗する関係にあり、PDAC細胞運命は、この二つの可溶性因子の逆方向性の調節によって決定されるとしています。
SPP1の腫瘍形成や転移における役割を明らかにしたという点で大変興味深い論文ですが、SPP1自体は破骨細胞(発現量が極めて高い)をはじめとして様々な細胞に発現しており、CD61のみが受容体ではなくRGD配列を有してインテグリンに結合します。ということで骨代謝研究者の観点からは少しできすぎストーリーのような気もします。
論文情報
Li, H., Lan, L., Chen, H. et al. SPP1 is required for maintaining mesenchymal cell fate in pancreatic cancer. Nature (2025).
https://doi.org/10.1038/s41586-025-09574-y






